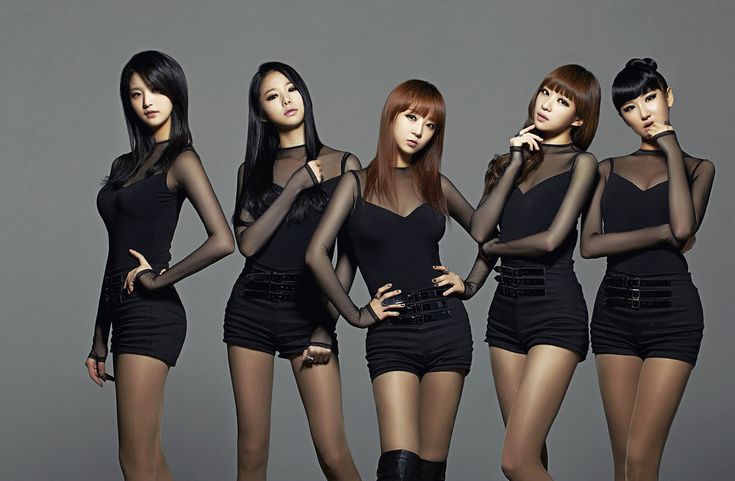Содержание
Южнокорейская гёрл-группа TREN-D — «Весенний отзыв о корейских девушках. И не только о них.»
Никогда ещё не писал об азиатской поп-культуре. Но привлекло внимание мелькание на экране симпатичных девушек с характерным разрезом глаз.
Девчачья группа TREN-D из Южной Кореи образовалась в 2013 году, а прекратила выступления в 2016-м. И за три года девчата оставили довольно яркий незабываемый след в Интернете.
Сначала расскажу о собственных впечатлениях. Пять симпатичных девушек с приятными фигурами ритмично и слаженно двигаются под простенькие поп-мотивчики. И в движениях ничего суперсложного (набор отрепетированных танцевальных блоков), и фоновая музыка довольно примитивная.
У некоторых из них есть микрофоны, но выступают они явно под «фанеру», что не удивительно: главное тут – именно визуальное удовольствие от танцев корейских девушек, синхронность движений которых доведена до совершенства.
В чём феномен TREN-D? – Ведь достаточно включить MTV, скажем для примера, и таких танцев и подтанцовок насмотришься! Столько обнажённых и полуобнажённых женских тел увидишь в каждом почти клипе! Такое вытворяют! И двигаются так слаженно-отрепетированно!
Я для себя нахожу такой ответ: у западных танцевальных артисток в сфере поп-культуры основной упор на порочность. Порок подразумевается в каждом движении, в каждом танцевальном па. А если, может, и не видно явно, но он исподволь напоминает о себе однозначно. И это часто подчёркивается внешним видом, – пирсинг, тату и минимальная одежда на телах танцующих западных гёрлз не оставляют никаких сомнений у зрителей в том, что «энти девушки» прошли «огонь, воду и медные трубы». Прошли сами и своими раскованными энергичными движениями как бы навязывают нам, зрителям, суперсвободу отношений.
А вот азиатская культура показывает нам совсем другие стандарты. Тут ещё надо учесть, что общественное мнение считает, что у азиатских девушек в поведении традиционная стыдливость и непорочность (вспомним, хотя бы, как они смеются, – обязательно прикрывают рот ладошкой). Так или не так это на самом деле – никто не пробовал, но устоявшееся мнение людей не изменишь.
Так или не так это на самом деле – никто не пробовал, но устоявшееся мнение людей не изменишь.
Вернёмся к девчачьей группе TREN-D из Южной Кореи. Синхронные движения юных стройных танцовщиц никогда не переходят границ приличного поведения на танцполе, а уж по сравнению с танцами на MTV и других западных музыкальных площадках кореянки просто показывают пример девственно чистых танцев, за которые им явно не стыдно перед родными и близкими (хорошо сказал!). Они как бы показывают нам: мы танцуем, но мы скромные невинные девушки, мы поём, но это приличные песни о том, о чём думают все девочки-подростки. И одеты они соответствующе для этой «чистой линии»: симпатично, опрятно и без грязных намёков на сексуальность.
Часто танцующие девушки из TREN-D носят на себе именно школьную форму из клетчатых юбочек и другие соответствующие школьным будням предметы одежды, как бы подчёркивая тем самым, что они юные и помыслы их чисты.
И тем самым повышают интерес к себе мужской части населения, на мой взгляд. Кто-то из мужчин пресытился «обнажёнкой», кому-то нравится, когда девушки и женщины ведут себя скромно и прилично, а количество просмотров растёт! И почитайте комменты к видео кореянок! Восторженно и влюблено комментируют наши мужчины танцы корейской гёрлз-группы! Нравится! Хотим ещё!
А они уже четыре года как распались. То одна придёт, а другая уйдёт, то неожиданные
перестановки, то снова изменение состава. То одна с лидер-вокалом заменит другую, то опять смена лидера. Смешно! – Какой тут вокал? Так петь может каждая вторая девушка в любом рейсовом автобусе! Вот как они танцуют, как приятно взлетают подолы юбочек при движениях, – вот это другое дело! И всё это с милыми застенчивыми улыбками, чисто и прилично. Как говорится, скромненько и со вкусом.
Как посмотреть на эту красоту? Набираете название коллектива на любом видеосайте, и – вуаля! Например, их шлягер «Candy boy» (а других, однако, и нет). «Candy boy» переводится «конфетный мальчик», «мальчик-леденец». О чём ещё могут петь карамельные девочки, похожие на кукол? И прилично это, и нравственность не затрагивается ничем.
«Candy boy» переводится «конфетный мальчик», «мальчик-леденец». О чём ещё могут петь карамельные девочки, похожие на кукол? И прилично это, и нравственность не затрагивается ничем.
Хочу порекомендовать просмотр видео с участием корейского танцевально-вокального коллектива TREN-D. Совсем скоро уже таких девчонок могут заменить или девочки-роботы или компьютером нарисованные девчата (прогресс!), а пока это – TREN-D из Кореи. Эх, весна, что ты делаешь с нами!
Приятного просмотра или прослушивания!
capitan Grant
Минутка залипания в ЖЖ )). Группа «TREN-D». Ну, просто лапочки ): stabrk — LiveJournal
?
Старший Брат Краткости (stabrk) wrote,
Category:
- Музыка getCancelledCats().length > 0″ ng-click=»catSuggester.reacceptAll()»> Cancel
Наслаждайтесь ))
Лень делать хоть какой-то поверхностных анализ-справку (информации много, оформлять просто долго со всеми ссылками и связным текстом и своими комментариями :), так что пока оставлю эту милоту здесь:
Распавшаяся южнокорейская девичья группа «TREN-D» в первом своём составе с двумя хитами нескольколетней давности: «Candy Boy» и «Jung» («Affection»).
1. Группа «TREN-D», композиция «Candy Boy» (на английском?) — их первый хит, в этой записи студийный звук (ниже на пятом видео тот же клип, но запись звука прямо с концерта):
https://www.youtube.com/watch?v=cEYPlrYdTy0
2. Группа «TREN-D», та же композиция «Candy Boy», ещё одно из первых выступлений, другой наряд (имидж, одежда), студийный звук, видео зеркально (поменяна левая и правая сторона):
https://www.youtube.com/watch?v=4AKTkXYWb5Q
3. Группа «TREN-D», ещё одна песня — «Jung» («Affection») (судя по всему, на корейском), официальный видеоклип:
https://www. youtube.com/watch?v=ljOmhMUdnxM
youtube.com/watch?v=ljOmhMUdnxM
4. Та же композиция «Jung» («Affection») — запись на радио (группа «TREN-D»):
https://www.youtube.com/watch?v=e4l_egMkiTc
5. Группа «TREN-D», две песни: «Candy Boy» и «Jung» («Affection»), звук не чистый студийный, а записан на выступлении (с шумами от зрителей и помехами от ветра), видео первой песни («Candy Boy») то же, что и в самой первой ссылке:
https://www.youtube.com/watch?v=qagZel4fuAs
(Копия: https://www.youtube.com/watch?v=LJi-inlR7A4)
6. Оригинал оранжированной как танцевальная песни «Jung» группы «TREN-D» — почти лирическая композиция «Affection» группы «Young Turks Club», официальный видеоклип:
https://www.youtube.com/watch?v=zyP5uob8nts
(Копия: https://www.youtube.com/watch?v=tQYxANatre0, https://www.youtube.com/watch?v=f6MJ87qTq8Y)
7. Группа «Young Turks Club», композиция «Affection», выступление на концерте (слышны фанатские писки):
https://www.youtube.com/watch?v=SXtjFlNd6Ao
8. Группа «Young Turks Club», композиция «Affection», выступление через много лет после создания песни, их тепло принимают зрители:
Группа «Young Turks Club», композиция «Affection», выступление через много лет после создания песни, их тепло принимают зрители:
https://www.youtube.com/watch?v=78Fi4Do5wf8
9. Ну, и раз пошла такая пьянка, пока январь — какая-то новогодняя песенка группы «Young Turks Club»:
https://www.youtube.com/watch?v=yeZq8NBpLWQ
10. Эта же новогодняя песенка группы «Young Turks Club» спустя много лет:
https://www.youtube.com/watch?v=byEz6cmfZCA
Subscribe
Ассоциация в кино и наяву
Всюду реклама нового фильма 2021 года «Вечные», при этом на постерах этой кинопродукции от «Marvel» минимум словесной информации, только фото…
Недолго музыка играла
Написал шуточный комментарий, что tema стучится ко мне в личку с просьбой прекратить обнародовать тот факт, что в «Студии Артемия…
Не ссыте, сейчас вам назову признак американского фильма
Если в фильме показали сцену, где главные герои беседуют в мужском туалете на фоне справления малой нужды и писсуаров, — в 99 случаях из 100 вы…
Photo
Hint http://pics. livejournal.com/igrick/pic/000r1edq
livejournal.com/igrick/pic/000r1edq
Периодические тенденции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 618
Периодические тренды — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать и связывать электроны. Поскольку электроотрицательность является качественным свойством, стандартного метода расчета электроотрицательности не существует. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Рисунок \(\PageIndex{1}\): Периодическая таблица значений электроотрицательности
Электроотрицательность измеряет тенденцию атома притягивать и образовывать связи с электронами. Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
- Слева направо по периоду элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его приобретения.
 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его. - Сверху вниз по группе электроотрицательность уменьшается. Это происходит потому, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром, или увеличивается атомный радиус.
- Важные исключения из вышеуказанных правил включают инертные газы, лантаноиды и актиноиды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны. Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
- Что касается переходных металлов, хотя они имеют значения электроотрицательности, между ними мало различий по периоду и вверх и вниз по группе.
 Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
В соответствии с этими двумя общими тенденциями наиболее электроотрицательным элементом является фтор с 3,98 единицами Полинга.
Рисунок \(\PageIndex{2}\): Периодическая таблица, показывающая тренд электроотрицательности
Тенденции энергии ионизации
Энергия ионизации – это энергия, необходимая для отрыва электрона от нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Рисунок \(\PageIndex{3}\): График, показывающий энергию ионизации элементов от водорода до аргона
Другим фактором, влияющим на энергию ионизации, является экранирование электронов . Электронное экранирование описывает способность внутренних электронов атома экранировать его положительно заряженное ядро от его валентных электронов. При движении вправо от точки увеличивается число электронов и увеличивается сила экранирования. В результате электронам валентной оболочки легче ионизироваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как скрининг .
Тенденции
- Энергия ионизации элементов внутри периода обычно увеличивается слева направо. Это связано со стабильностью валентной оболочки.
- Энергия ионизации элементов внутри группы обычно уменьшается сверху вниз. Это происходит из-за электронного экранирования.

- Благородные газы обладают очень высокими энергиями ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что у гелия самая высокая энергия ионизации среди всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней или наивысшей энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий высокоэнергетический электрон из газообразного катиона и т. д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
Как правило, любые последующие энергии ионизации (2-я, 3-я и т. д.) следуют той же периодической тенденции, что и первая энергия ионизации.
Рисунок \(\PageIndex{4}\): периодическая таблица, показывающая тренд энергии ионизации
Энергия ионизации уменьшается по мере увеличения атомного радиуса. На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
- Через период \(Z_{eff}\) увеличивается на , а n (главное квантовое число) остается тем же самым , поэтому энергия ионизации увеличивается на .
- Вниз по группе \(n\) увеличивает и \(Z_{eff}\) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства к электрону
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \(\PageIndex{5}\): периодическая таблица, показывающая тренд сродства к электрону
Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тренд атомного радиуса, обсуждаемый ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
- Сродство к электрону увеличивается слева направо в пределах периода. Это связано с уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это связано с увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус равен половине расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея усложняется тем фактом, что не все атомы обычно связаны друг с другом одинаковым образом. Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Размер атома постепенно уменьшается слева направо по периоду элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более положительно заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение. Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Рисунок \(\PageIndex{6}\): Периодическая таблица, показывающая тренд атомного радиуса
D собственная группа, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n». Экранирование электронов предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшает слева направо в течение периода. Это вызвано увеличением числа протонов и электронов за период. Один протон имеет больший эффект, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается сверху вниз внутри группы. Это происходит из-за электронного экранирования.

Тенденции изменения температуры плавления
Температура плавления — это количество энергии, необходимое для разрыва связи (связей) для превращения твердой фазы вещества в жидкость. Как правило, чем прочнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Точки плавления различны и обычно не образуют различимой тенденции в периодической таблице. Однако из рисунка \(\PageIndex{7}\) можно сделать определенные выводы.
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов имеют низких температур плавления .
- Неметалл углерод обладает самой высокой температурой плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Рисунок \(\PageIndex{7}\): Таблица температур плавления различных элементов
Тенденции металлического характера
Металлический характер элемента можно определить как легкость, с которой атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
- Металлические характеристики уменьшаются слева направо по периоду. Это вызвано уменьшением радиуса (вызванного Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики увеличиваются вниз по группе. Электронное экранирование вызывает увеличение атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.

- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один более простой способ запомнить тенденцию металлического характера состоит в том, что при движении влево и вниз по направлению к нижнему левому углу периодической таблицы металлический характер увеличивается по направлению к группам 1 и 2, или группам щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к правому верхнему углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Переместиться влево по периоду и вниз по группе: увеличить металлический характер (в сторону щелочных и щелочных металлов)
- Перемещение вправо по периоду и вверх по группе: уменьшение металлического характера (в направлении неметаллов, таких как благородные газы)
Рисунок \(\PageIndex{8}\): Тенденция периодической таблицы металлических свойств
Задачи
Следующая серия задач проверяет общее понимание вышеупомянутого материала.
1. Основываясь на периодических трендах энергии ионизации, какой элемент имеет наибольшую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (Не)
2.) Азот имеет больший атомный радиус, чем кислород.
- А.) Правда
- Б.) Ложь
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицательный, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке уменьшения эффективного заряда ядра на валентные электроны: Si, Al, Mg, S
8) Перепишите следующий список в порядке уменьшения сродства к электрону: фтор (F), фосфор (P) , сера (S), бор (B).
9) Атом с атомным радиусом меньше, чем у серы (S), это __________.
- А.) Кислород (О)
- B.) Хлор (Cl)
- С.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- А.) Верно Б.) Ложно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет наибольшую энергию ионизации, потому что, как и у других благородных газов, валентная оболочка гелия заполнена. Следовательно, гелий стабилен и с трудом теряет или приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Радиус атома увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Объяснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по столбцу. Свинец находится под оловом, поэтому свинец имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: В неметаллах температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одной колонке. Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полные валентные оболочки.
Пояснение: Из-за полной валентной электронной оболочки инертные газы чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S > Si > Al > Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый чувствует притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)>Сера (S)>Фосфор (P)>Бор (B)
Пояснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Объяснение: Периодические тренды показывают, что атомный радиус увеличивается вверх по группе и слева направо по периоду. Поэтому кислород имеет меньший атомный радиус серы.
Поэтому кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, превращаясь в ион, а неметалл приобретает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения размеров атомов». J. Chem. Образовательный 1998 75 725.{cke_protected}{C}
- Куреши, Пушкин М.; Камунпури, С. Икбал М. «Сольватация ионов: проблема ионных радиусов». J. Chem. Образовательный 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Образовательный 1993 , 70 , 368.

- Руссо, Стив и Майк Сильвер. Введение в химию. Сан-Франциско: Пирсон, 2007.
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007.
- Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Альберти, Роберт А. и др. ал, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc, pg. 380.
- Котс, Джон К. и др. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, pg. 305-309.
.
.
Periodic Trends распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Света Рамиредди, Бинъяо Чжэн, Эмили Нгуен и Эмили Нгуен.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Теги
- Атомный радиус
- автор @ Бинъяо Чжэн
- автор @ Эмили Нгуен
- автор @ Света Рамиредди
- Электронное сродство
- электроотрицательность
- Тенденции электроотрицательности
- Энергия ионизации
- температура плавления
- металлический символ
- периодический закон
- периодическая таблица
- Периодические тренды
- Тренды
Различные свойства и тенденции элементов D-блока
Рон Б.
 Дэвис-младший, Джорджтаунский университет
Дэвис-младший, Джорджтаунский университет
Хотя все элементы d-блока представляют собой металлы, в некоторых отношениях их свойства не могут быть намного более разными . Например, d-блок содержит вольфрам, элемент с самой высокой температурой плавления во всей таблице. Но всего через шесть мест мы сталкиваемся с ртутью, единственным металлическим элементом, который плавится при температуре ниже комнатной. Так как же объяснить эти тенденции?
Осмий имеет плотность почти в три раза больше плотности железа и является самым плотным элементом во всей периодической таблице. (Изображение: LuYago/Shutterstock)
Diverse Properties
Давайте сравним титан с осмием. Плотность титана составляет всего около двух третей плотности железа. Осмий, с другой стороны, имеет плотность почти в три раза больше, чем железо, и является самым плотным элементом во всей периодической таблице.
Какими бы разнообразными ни были некоторые из этих свойств, они очень систематически распространяются по кварталу. Если мы применим наше понимание строения атома, то вполне возможно объяснить эти тенденции.
Если мы применим наше понимание строения атома, то вполне возможно объяснить эти тенденции.
Для этого сначала рассмотрим атомный радиус.
Атомные радиусы элементов D-блока
Для элементов s- и p-блока существует сильная и закономерная тенденция к уменьшению атомного радиуса при движении слева направо и неуклонному увеличению внутри группа, когда мы движемся вниз.
Но когда мы исследуем элементы d-блока, мы видим нечто немного другое. Их атомные радиусы плавно и довольно последовательно уменьшаются при движении слева направо. Эта тенденция начинает отклоняться только тогда, когда мы достигаем групп в конце блока, где d-подоболочка начинает полностью заполняться.
Но, продвигаясь вниз по группе, мы видим, что атомные радиусы элементов в периодах 5 и 6 почти одинаковы.
Конфигурации оболочки размера и валентности
Причина этого в том, что мы должны учитывать заполнение f-подоболочки, которое происходит в период 6 до заполнения d-подоболочки. Итак, с одной стороны, ядра переходных металлов из рядов 6 имеют гораздо больше положительно заряженных ядер для втягивания электронов, чем более мелкие переходные металлы. А с другой стороны, добавленные электроны f-подоболочки не очень эффективно экранируют валентные электроны от всех этих ядер.
Итак, с одной стороны, ядра переходных металлов из рядов 6 имеют гораздо больше положительно заряженных ядер для втягивания электронов, чем более мелкие переходные металлы. А с другой стороны, добавленные электроны f-подоболочки не очень эффективно экранируют валентные электроны от всех этих ядер.
Подобный размер и аналогичная конфигурация валентной оболочки также объясняют, почему элементы d-блока 5-го и 6-го рядов в одной группе так часто встречаются вместе в природе.
Например, ниобий и тантал были обнаружены с разницей всего в один год при использовании одного и того же исходного минерала. А цирконий и гафний настолько похожи, что гафний фактически не был обнаружен более чем через столетие после циркония.
Эта статья взята из серии видео Понимание периодической таблицы . Смотрите прямо сейчас на Wondrium .
Точки плавления
По мере того, как мы движемся вниз и вправо по d-блоку, увеличение массы ядра также способствует увеличению плотности. Это объясняет, почему элементы шестого ряда, такие как осмий, иридий, платина и золото, имеют очень высокую плотность, в то время как переходные металлы раннего третьего ряда, такие как титан и ванадий, имеют одни из самых низких плотностей для всего блока.
Это объясняет, почему элементы шестого ряда, такие как осмий, иридий, платина и золото, имеют очень высокую плотность, в то время как переходные металлы раннего третьего ряда, такие как титан и ванадий, имеют одни из самых низких плотностей для всего блока.
Когда дело доходит до температуры плавления, в d-блоке проявляется еще одна сильная тенденция. Во-первых, практически все эти металлы имеют относительно высокие температуры плавления с резким спадом только в двух последних столбцах блока. Во-вторых, в d-блоке имеется четкая вертикальная тенденция увеличения температуры плавления по мере продвижения вниз по столбцу, и это имеет смысл.
Чтобы это понять, возьмем колонку группы 6 из хрома, молибдена и вольфрама. Каждый раз, когда мы переходим к следующему ряду, мы добавляем дополнительный энергетический уровень электронов, которые лучше экранированы от ядра, делая эти валентные электроны более доступными для металлической связи. Более прочные металлические связи означают более высокую температуру плавления.
Тенденция между рядами
Высокая температура плавления вольфрама означает, что его нити могут выдерживать экстремальные температуры. (Изображение: Юлия Хуржос/Shutterstock)
Вольфрам является ценным металлом именно по этой причине. Его высокая температура плавления означает, что вольфрамовые нити могут выдерживать экстремальное тепло, выделяемое при генерировании света в лампах накаливания без плавления нити.
Теперь обратим внимание на тренд по строкам. Это очень необычно выглядящая тенденция, при которой точки плавления сначала увеличиваются, когда мы движемся слева направо по периоду, но только примерно до середины пути. После этого точки плавления обычно снижаются по мере того, как мы продолжаем движение.
Сначала движение слева направо по d-блоку приводит к добавлению в атом большего количества неспаренных электронов. Каждый дополнительный неспаренный электрон означает более прочную металлическую связь, которая может образоваться.
Группа 7
Итак, по мере продвижения по группам элементов d-блока 3, 4, 5 и 6 наблюдается четко выраженная тенденция к увеличению температуры плавления. Но в группе 7 происходит нечто другое, особенно в верхнем ряду блока d, где марганец имеет гораздо более низкую температуру плавления, чем хром. Если присмотреться, то можно увидеть аналогичную особенность для технеция и рения в периоды 5 и 6.
Но в группе 7 происходит нечто другое, особенно в верхнем ряду блока d, где марганец имеет гораздо более низкую температуру плавления, чем хром. Если присмотреться, то можно увидеть аналогичную особенность для технеция и рения в периоды 5 и 6.
Что такого особенного в группе 7 элементов D-блока? Почему металлические связи в этих элементах слабее, чем у их предшественников на столе? Это связано с тем, что необычная степень стабильности может быть достигнута за счет наполовину заполненных подоболочек. Атомы марганца обладают некоторой дополнительной стабильностью, когда они сохраняют все свои электроны, благодаря тому, что они являются металлом 4s2-3d5.
Непарные электроны
Но как только мы перейдем к группе 8 и далее элементов d-блока, эффект наполовину заполненной подоболочки перестанет действовать. Кажется, что точки плавления уменьшаются по мере того, как мы продолжаем движение по d-блоку. Это из-за неспаренных электронов. В левой части блока каждый новый d-электрон означает еще один d-электрон, доступный для металлической связи.
Напротив, во второй половине d-подоболочка становится переполненной, ее орбитали принимают все больше и больше электронных пар, делая все меньше d-орбитальных электронов доступными для металлической связи.
К тому времени, как мы доберемся до группы цинка, у нас уже есть закрытые s- и d-подоболочки без неспаренных электронов. Здесь вклад d-подоболочки в металлическую связь полностью исчерпан, что делает элементы группы цинка более похожими на «слабые металлы».
Общие вопросы о различных свойствах и тенденциях элементов D-блока
В: Какое свойство вольфрама делает его ценным ?
Высокая температура плавления вольфрама означает, что его нити накаливания могут выдерживать экстремальное тепло, выделяемое при генерировании света в лампах накаливания без плавления нити накала.
В: Какой вертикальный тренд виден, когда мы двигаемся вниз по столбцу?
Внутри элементов d-блока прослеживается четкая вертикальная тенденция повышения температуры плавления по мере продвижения вниз по столбцу.
 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.